瑞德西韦孤儿药资格引起争议 吉利德申请取消
记者获悉,吉利德已经向美国食品药品管理局(FDA)提交申请,要求取消其授予新型冠状病毒肺炎的在研抗病毒药物瑞德西韦(remdesivir)的孤儿药资格,同时放弃与该资格认定相关的所有权益。
吉利德表示,公司有信心,在没有孤儿药资格的情况下,也可以继续对瑞德西韦监管审评的快速推进。公司与监管机构最近的沟通互动表明,与瑞德西韦治疗新型冠状病毒肺炎相关的材料提交和审评正在加速。
据了解,在3月初,吉利德寻求并随后获得了瑞德西韦作为新型冠状病毒肺炎潜在治疗方案的孤儿药资格。在美国,疾病影响的患者人数少于20万的情况下,FDA会授予孤儿药资格。
“孤儿药”又称为罕见药,用于预防、治疗、诊断罕见病的药品,由于罕见病患病人群少、市场需求少、研发成本高,很少有制药企业关注其治疗药物的研发,因此这些药被形象地称为“孤儿药”。
美国政府规定,美国境内治疗病人数少于20万的药品可申请孤儿药资格,还能获得50%的税收抵免、新药申请费减免等其他优惠。此外,孤儿药的一项特权是一旦药物上市,相关公司可以有高达7年的独占期,美国法律将禁止其他公司仿制这种药物。
吉利德介绍,与孤儿药认定相关的权益中,这一资格的获得可以免除在提交新药申请之前提供儿科研究计划的要求——该过程的审评时间可能长达210天。
不过,数据显示,除中国以外,确诊病例过万的国家有意大利、美国、西班牙、德国、伊朗和法国。疫情已波及全球160多个国家和地区。
美国约翰斯·霍普金斯大学24日发布的最新数据显示,截至美国东部时间24日13时30分(北京时间25日1时30分),全球新冠肺炎确诊病例超过40万例,达到407485例。全球死亡病例达18227例。这些数据来自约翰斯·霍普金斯大学新冠病毒研究项目实时汇总的各个国家和地区数据。
在成为全球大范围出现新冠肺炎疫情中,瑞德西韦被认定为孤儿药引发争议。
对此,吉利德表示,公司认识到新型冠状病毒肺炎大流行造成的紧急公共卫生需求。公司正在尽全力推进瑞德西韦的快速开发,并将及时提供情况更新。
标签: 瑞德西韦
您可能也感兴趣:
为您推荐
综合实力够强,智路建广完全符合紫光重整管理人要求
智路建广管理模式和盈利能力向好,紫光集团重组未来可期!
康师傅“急难救助车” 救灾一线一碗热面暖人心
排行
- 银华中证农业主题ETF基金净值上涨2.90% 场内价格溢价率为0.04%
- 易方达中证红利ETF基金净值上涨1.28% 场内价格溢价率为0.02%
- 广发中证全指原材料ETF基金净值上涨1.38% 场内价格溢价率为-0.99%
- 博时黄金ETF基金净值上涨1.22% 场内价格溢价率为-0.26%
- 建信中证智能电动汽车ETF基金净值下跌1.21% 场内价格溢价率为0.16%
- 华夏创业板ETF基金净值下跌1.18% 场内价格溢价率为0.27%
- 华夏中证新能源ETF基金净值下跌1.17% 场内价格溢价率为0.16%
- 华宝新材料ETF基金净值下跌1.17% 场内价格溢价率为0.02%
- 华夏中证动漫游戏ETF基金净值下跌1.10% 场内价格溢价率为-0.05%
- 华宝深证创新100ETF基金净值下跌1.19% 场内价格溢价率为-0.04%
精彩推送
- 国内商品期货开盘普涨 沪镍涨近4%
- 复星医药、博瑞医药双双涨停开盘
- 旅游股开盘领涨
- 军工股开盘大幅走低 多股跌超9%
- 国产软件板块持续走强
- 明日主题前瞻:价格创十年新高 需求占比或提升5倍以上 特斯...
- 西点药业募投项目信披现罗生门 税收优惠或难“无缝衔接”
- 股市早8点丨注意到北向资金“牛尾跑步进场抄底扫货”
- 冬天“最火”项目 冰雪旅游12月开始保持周均超40%增长
- 国产剧《开端》爆了!它们成功押宝 两家上市公司在列 还有...
- “顶流”张坤在管规模1019.36亿,再度小幅缩水,增减仓动作全...
- 城市减碳空间有多大
- 贸发会议:2021年全球外国直接投资强劲反弹
- 下调首付比例!多地楼市调控松动,从公积金买房开始
- LPR罕见“双降息”,房贷月供变少!买房更容易了?
- 我钱都去哪了?2021年居民消费榜告诉你
- 油价攀升是暂时现象还是长期趋势
- 中国最大超稠油油田累计生产原油超2000万吨
- 深圳盐田港2021年集装箱吞吐量达1416.11万标箱
- 农业农村部:春节、冬奥会期间“菜篮子”供应充足
- 住建部:坚决有力处置个别头部房企项目逾期交付风险
- 青海政协委员:以环保为目标打造中国碱都
- 耕地资源有限 中国官方回应如何扩种大豆
- 十问中国经济2022:如何增强创新“第一动力”?
- 春节恰逢冬奥,肉蛋奶果菜鱼供应总量充足!
- 中科环保、BYD半导、工大科雅1月27日创业板首发上会
- TMT时报|字节跳动2021年日均进账10.7亿元人民币 中兴旗下手...
- 竞争力超强!基金经理称光伏产业链值得重点挖掘
- 湖北GDP迈上5万亿元台阶 疫后经济强势复苏重振
- 重庆直飞香港客运航线复航
- 福布斯发布2022年美国慈善富豪25强 巴菲特居首
- 青客租房申请破产清算 曾为国内长租公寓第一股
- 报告:中国科技企业仍将引领办公楼需求增长
- 贝恩:2025年中国有望成为全球第一大奢侈品市场
- 国家发展改革委指导各地推出系列举措 全力做好春节期间重要...
- 农业农村部:2021年粮食产量创新高
- 到2025年我国实现沿海港口重要港区铁路进港率超70% 枢纽机场...
- 山西省政协委员刘兴亮:用“元宇宙”打造数字文旅新业态
- 粤政协委员建言:建立跨境电商行业标准 打造产业生态链条
- 中药创新药密集获批上市!片仔癀3款中药新药在研 未来3~5年...
- 预制菜再成资本市场新宠,万亿市场谁是赢家?
- 中石化近亿元投资博清科技,首入机器人赛道
- 又一起“青花椒”案二审胜诉,成都商户:准备申请自己的商标
- 以智能化破题转型升级 重庆加速打造“智造重镇”
- 海关总署:2022年促进跨境贸易便利化专项行动启动
- 浙江省消保委发布春节消费提示:办卡续费要谨慎
- 渝昆高铁川渝段站前四标首个连续梁浇筑合龙
- 住建部:加强房地产市场调控 坚持“房住不炒”
- 五部门调整疫情期间免税店经营和招标期限规定
- 新疆铁路货运发送量突破1000万吨 实现新年开门红
- 深交所网站显示 比亚迪半导体股份有限公司审核状态变更为已问询
- 【数据看盘】外资扫货大金融 一银行股连续四日买入居首
- 创业板上市委:比亚迪半导体等三家企业首发1月27日上会
- 北向资金今日净流入125.76亿元 大幅净买入中国平安13.53亿元
- 龙虎榜:2.52亿抢筹拓新药业 外资净买2股 机构净买6股
- 1月20日晚间上市公司利好消息一览(附名单)
- 个股普跌!大金融板块逆市护盘 流动性环境向好 机构:关注...
- 百世集团因交通事故新增被执行人 执行标的127.74万元
- 农业农村部:适当提高小麦、稻谷最低收购价
- 拼多多与美的集团合作:年销售额破100亿共同推动数实融合
- 公益是社区的基因,哔哩哔哩公益平台正式上线
- 四川两会聚焦“双碳”目标 多领域发力打通绿色发展之路
- 地产股债大涨!LPR“降息”落地,房贷少了!还释放哪些信号?
- 足力健新增被执行信息 执行标的为128万元
- 多家公司元宇宙商标被驳回
- 游戏人均支出344元,氪金王腾讯、网易现吃老本隐忧
- 当“织布机”变成“断魂刀” 一场万亿成交下的存量博弈
- 港股招商局中国基金:附属公司完成出售寒武纪股份 获得分配...
- [情绪与偏差]震荡弱势 个股补跌
- 逆势大涨 重要信号释放!
- 投诉量超6000条 新老IP交替明显!股价走低泡泡玛特如何破局?
- 北向资金今日净买入125.76亿元(附股)
- 北向资金今日净买入125.76亿 净买入招商银行17.1亿、中国平安13.53亿
- 名将傅友兴最新持仓:贵州茅台退出十大重仓股 增持轻工、汽...
- 四川两会聚焦“双碳”目标 多领域发力打通绿色发展之路
- 贵州省2021年白酒产量34.81万千升 同比增长30.5%
- 商务部:取消加征关税符合中美两国消费者和生产者的根本利益
- 广东城市地价动态监测报告发布 深圳31758元/平方米居首
- 青海:2025年枸杞产业年产值将突破100亿元以上
- 农业农村部:千方百计夺取今年夏粮小麦丰收
- 农业农村部:2021年脱贫人口人均实现产业增收超2200元
- 从地方两会看“数字长三角”:发力加速跑 提升全球话语权
- 农业农村部:2021年猪肉产量基本达到历史正常年份水平
- 农业农村部:预计未来3个月菜价将比较坚挺
- 开年来新基金成立总规模542亿 不足去年同期1/6
- 北向资金尾盘加速抄底
- 北向资金尾盘净流入超150亿元
- 北向资金抢筹125亿!金融股走强 逾3800只股下跌
- 和信投顾:大盘早盘探底回升 超3600只个股下跌
- 地产债整体走高
- 五大上市险企2021揽2.49万亿保费 2022保险业能否走出资产负...
- 和信投顾:指数缩量整理 金融扛起大梁
- 年内最赚新股诞生:N诚达破发潮中一枝独秀 单签最高盈利超5万元
- 复盘50涨停股:九安医疗、精华制药、翠微股份封板 湖北广电炸板
- 三胎概念股大涨 国家卫健委称将研究出台更多积极生育支持措施
- 恒指大涨逾3%逼近25000点 科技指数飙升4.5%
- 【每日收评】北向资金超百亿买入难挡两市普跌局面!资金抱团...
- 河南安阳:职工治疗观察隔离期间需支付报酬
- 摄像头遭破解视频成“套餐”?猎奇扭曲的买家和卖家
- 河南外贸进出口总额首次突破8000亿

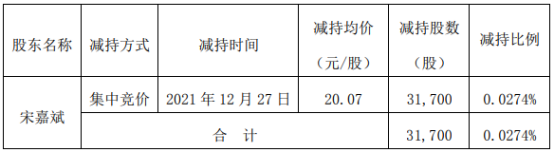
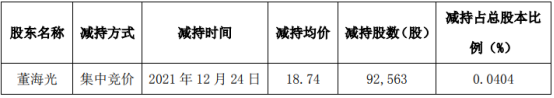
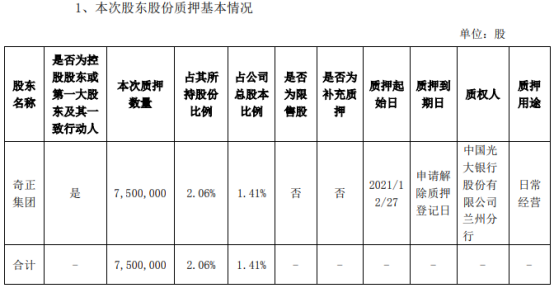



 营业执照公示信息
营业执照公示信息